Aujourd'hui, je vais vous parler d'un concept très important en chimie : l'oxydoréduction. Le nom peut vous paraître un peu tordu, mais pourtant c'est un concept que vous rencontrez au quotidien.
Les réactions d'oxydoréduction sont un peu partout : dans vos piles et vos batteries, sur la surface de votre voiture, sur les toits en cuivre ou tout simplement sur les objets et infrastructures en fer.

L'oxydoréduction : un transfert d'électrons
Oxydant : espèce qui capte des électrons.
Réducteur : espèce qui cède des électrons.
Une oxydation correspond à une perte d'électrons.
Une réduction correspond donc à un gain d'électrons.
Lors d'une réaction d'oxydoréduction, l'oxydant est réduit, et le réducteur est oxydé.
Le degré d'oxydation (ou nombre d'oxydation)
Le degré d'oxydation (ou nombre d'oxydation) sert à exprimer le niveau d'oxydation des atomes et des ions. Plus un élément est oxydé, plus ce nombre est important.
On peut considérer que le nombre d'oxydation est la charge qu'aurait un atome si tous les électrons de liaison étaient attribués à l'élément le plus électronégatif.
Quelques règles...
- Pour un atome dans son état élémentaire (par exemple Cu), le degré d'oxydation est égal à 0.
- Pour les ions monoatomiques (O2, H2, Br2, etc), le d.o. est égal à la charge de l'ion. Par exemple, pour Cu2+, le d.o. sera 2.
- Dans les composés, certains atomes peuvent avoir un d.o. positif, négatif ou nul. La somme des degrés d'oxydation doit être égale à la charge totale du composé. Par exemple, ans le sulfate de magnésium, MgSO4, Mg a un d.o. de +2, S a un d.o. de +6 et O a un d.o. de -2.
- Dans les composés, l'oxygène a généralement un nombre d'oxydation égale à -2. Cependant, ça n'est pas toujours le cas.
Les piles, une utilisation de l'oxydoréduction
Savez-vous comment fonctionnent les piles et les batteries ? Réponse : sur le principe de l'oxydoréduction.
Un exemple simple est celui de la pile galvanique. Celle-ci est constituée de deux électrodes métalliques baignant dans des solutions. Par exemple, on peut avoir une électrode de zinc et une électrode de cuivre. On a donc deux demi-piles.
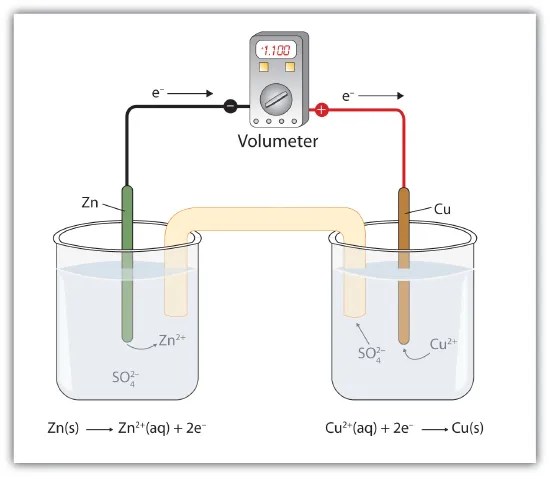
Dans une pile, on a une électrode positive et une électrode négative. L'électrode positive (+) est appelée cathode. L'électrode négative (-) est appelée anode. Des réactions d'oxydoréduction ont lieu à la cathode et à l'anode.
La réduction se produit à la cathode, et l'oxydation se produit à l'anode. Dans une pile galvanique avec une électrode en zinc et une électrode en cuivre, l'anode est en zinc et la cathode est en cuivre. Le zinc solide est oxydé en ions Zn2+, et les ions Cu2+ sont réduits en cuivre solide.
Les électrons ayant une charge négative, ils sont attirés par le côté positif.
Oxydation (anode) : Zn(s) → Zn2+ + 2 e-.
Réduction (cathode) : Cu2+ + 2 e- → Cu(s).
Réaction : Zn + Cu2+ → Zn2+ + Cu.
La corrosion, une oxydation non désirée
Savez-vous pourquoi certains métaux ont tendance à rouiller en extérieur ? C'est le résultat d'une oxydoréduction. La corrosion est le phénomène d'oxydation des métaux par un oxydant.
Les métaux peuvent être oxydés par l'oxygène de l'air, mais aussi par l'eau ou par des acides.
Mais pourquoi l'oxygène oxyde-t-il les métaux ? Tout simplement parce qu'il a tendance à être facilement réduit. En parallèle, les métaux qui réagissent avec l'oxygène sont donc facilement oxydés.

La rouille est issue de l'oxydation du fer solide en fer(II).
L'oxygène est réduit.
On combine les deux réactions.
Par la suite, les ions Fe2+ sont oxydés par l'oxygène de l'air pour former de l'oxyde de fer III (Fe2O3). Fe2O3 contient des ions Fe3+.
L'ensemble constitué par le fer, l'oxygène et l'eau peut être assimilée à une sorte de pile. Le fer constitue la région anodique, tandis que l'oxygène constitue la région cathodique.
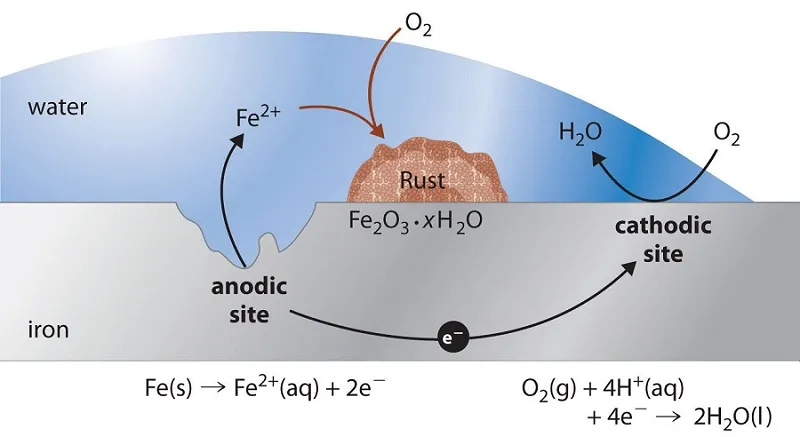
Le dioxygène est réduit par les H+.
Pour protéger les métaux contre l'oxydation, plusieurs solutions sont possibles. L'une d'entre elles consiste à appliquer une peinture spéciale pour isoler un métal de l'oxygène de l'air. C'est pour ça que la Tour Eiffel (qui est construite en fer puddlé) est recouverte d'une couche de peinture protectrice pour lui éviter de se transformer un fragile édifice rouillé...

On peut aussi utiliser un autre métal comme couche de protection. La galvanisation consiste à recouvrir un métal par une fine couche de zinc (Zn). Cette technique est par exemple utilisée pour protéger les clous et les vis. Le zinc s'oxyde plus facilement que le fer et forme une fine couche d'oxyde de zinc (ZnO), ce qui permet de protéger le fer.

On peut utiliser des métaux qui s'oxydent plus facilement que le fer, mais on peut aussi utiliser des métaux plus difficilement oxydables, par exemple le chrome (Cr). C'est notamment le cas dans la fabrication de **l'acier inoxydable (inox) ** qui est un alliage de fer, de carbone et de chrome.

Vous pouvez trouver des objets en inox un peu partout, par exemple dans votre cuisine. (Avouez que c'est mieux quand les ustensiles de cuisine ne rouillent pas...)

La lutte contre la corrosion, un enjeu économique
Lutter contre la corrosion est une nécessité pour assurer la solidité des objets et des structures. Lorsqu'un métal rouille, il devient beaucoup plus fragile. La lutte contre la corrosion est un enjeu de sécurité, mais aussi un enjeu économique : entretenir les structures et remplacer les pièces corrodées coûte cher. D'après les estimations de la World Corrosion Organization (WCO), le coût de la corrosion représenterait 3 à 4% du produit intérieur brut (PIB) des pays industrialisés !
Les métaux dotés d'un traitement anticorrosif coûtent généralement plus cher à produire. Si les entreprises et les collectivités prenaient davantage en compte le problème de la corrosion, elles pourraient faire des économies substantielles sur les coûts d'entretien et de remplacement.

Sources
- "Principes de chimie", Atkins, Jones et Laverman, éditions De Boeck Supérieur.
- "Principes de chimie : une approche moléculaire", Nivaldo J. Tro, éditions Pearson.
- Wikimedia Commons
- https://opentextbc.ca/chemistry/chapter/17-2-galvanic-cells/
- https://www.futura-sciences.com/sciences/definitions/chimie-corrosion-2072/
- https://www.projet-diamond.com/enjeux-economiques
- https://www.toureiffel.paris/fr/le-monument/peinture-tour-eiffel
- https://pixabay.com/fr/l-architecture-ville-tour-eiffel-1854130/
- https://pixabay.com/fr/vis-outil-r%C3%A9paration-fermer-3111098/
- https://pixabay.com/fr/inoxydable-wagon-trains-230041/
- https://pixabay.com/fr/ustensiles-de-cuisine-cuisson-3083125/