English (deutsche Übersetzung unten!)
Today I would like to open up the next round of my #chemistrychallenge.
What could be more fun than activating your brain and at the same time having the opportunity to win up to 20 STEEM. :-)
Rules - what are the requirements to win the prize?
The winner is the first person to post the correct solutions (correct numbers and correct units; solution process required). The prize for the correct answers is 20 STEEM. I will send it to the winner immediately after the article is paid out (seven days after posting).
Should the various solutions be spotted by different users I will distribute the prize money of altogether 20 STEEM at my own discretion amongst the winners.
If nobody is able to determine the solutions before Thursday, February 1st, 2018 at 10 pm (German time!) the prize (20 STEEM) will be sent to the person with the best approach.
Special thanks to the SteemSTEM community! They support this challenge which means that they contribute half of the prize money (= 10 STEEM)! In my eyes this still growing science community adds a lot of value to our Steemit platform! If you are interested in 'STEM' (= Science, Technology, Engineering, Mathematics) you may check their blog and read their last project update.
Your Chemistry Challenge to Solve:
The mass of all worker bees within a beehive in summer is about 4 kg.
10 bees have an overall mass of 1 g.
Within 20 days one single bee collects enough nectar to produce 9 g of honey (about one teaspoon).
Let's assume that the honey contains 80 % (mass percentage) sugar from which 37.5 % are glucose (C6H12O6). The molar mass of glucose is M(C6H12O6) = 180 g/mol.
Questions:
a)
Let's assume that all worker bees of this beehive would collect nectar simultaneously.
- How many minutes would they need to collect enough nectar to produce exactly 500 g honey?
- How many mols and how many molecules of glucose would that amount of honey contain?
b)
|
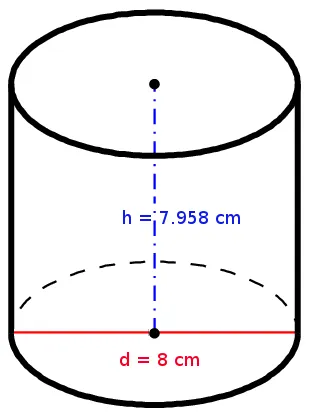
The 500 g honey fit into a cylindrical honey jar.
What is the density of the honey? |
|
c)
Now let's assume that you eat exactly one-tenth of the honey in this honey jar to be fit enough to solve the last part of the challenge. :)
In your metabolism the glucose contained in the eaten honey is now oxidized by means of oxygen to CO2 and H2O (process of cellular respiration).
Which amount of energy ΔHR will be released from the eaten glucose during this degradation process?
Let's assume that under the given conditions (pressure, temperature) the following molar enthalpies of formation would apply:
ΔHf(H2O) = - 285.9 kJ/mol.
ΔHf(CO2) = - 393.5 kJ/mol.
ΔHf(C6H12O6) = - 1268 kJ/mol.

Deutsch
Heute möchte ich die nächste Runde meiner #chemistrychallenge eröffnen.
Was könnte mehr Spaß bereiten, als mal wieder sein Gehirn zu aktivieren und dabei zugleich die Gelegenheit zu ergreifen, bis zu 20 STEEM zu gewinnen. Also macht euch an die Arbeit! :-)
Regeln - welche Bedingungen müssen erfüllt sein, um den Preis zu gewinnen?
Gewinner ist derjenige, der zuerst die korrekten Lösungen (korrekte Zahlen und korrekte Einheiten; Lösungsweg erforderlich) nennt. Der Preis für die korrekten Antworten beträgt insgesamt 20 STEEM. Ich werde ihn dem Gewinner direkt nach der Vollendung der Auszahlungsperiode dieses Artikels (also sieben Tage nach seiner Veröffentlichung) gutschreiben.
Sollten die verschiedenen Lösungen von verschiedenen Usern gefunden werden, verteile ich das Preisgeld von insgesamt 20 STEEM nach eigenem Ermessen unter den Gewinnern.
Solle niemand die Lösungen vor Donnerstag, den 01.02.2018 um 22:00 Uhr (deutsche Zeit!) herausfinden, wird der Preis (20 STEEM) demjenigen gutgeschrieben, der den besten Lösungsansatz vorzuweisen hatte.
Mein besonderer Dank gilt der SteemSTEM-Community, die diese Challenge unterstüzt, indem sie die Hälfte des Preisgeldes (= 10 STEEM) beisteuert! In meinen Augen ist diese noch wachsende Wissenschafts-Community ein wertvoller Bestandteil der Steemit-Plattform! Wenn du dich für 'STEM' (= Science, Technology, Engineering, Mathematics) interessierst, empfehle ich dir, ihren Blog anzusehen und das letzte Projekt-Update zu lesen.
Hier nun die zu lösende 'Chemistry Challenge':
Die Masse aller Arbeitsbienen eines Bienenvolks im Sommer betrage 4 kg.
10 Bienen haben eine Masse von zusammen 1 g.
Innerhalb von 20 Tagen sammelt eine einzelne Biene genug Nektar, um davon 9 g Honig (ungefähr den Inhalt eines Teelöffels) produzieren zu können.
Angenommen, der Honig enthalte 80 % (Massenanteil) Zucker, wovon 37,5 % Glucose (C6H12O6) seien. Die molare Masse von Glucose beträgt M(C6H12O6) = 180 g/mol.
Fragen:
a)
Nehmen wir an, alle Arbeitsbienen des Bienenvolks würden gleichzeitig Nektar sammeln.
- Wie viele Minuten würden sie benötigen, um genug Nektar zu sammeln, um davon genau 500 g Honig zu produzieren?
- Wie viel mol und wie viele Moleküle Glucose wären in dieser Honigmenge enthalten?
b)
|
Die 500 g Honig passen in ein zylinderförmiges Honigglas.
Was ist die Dichte des Honigs? |

|
c)
Lasst uns nun annehmen, du würdest genau ein Zehntel des in diesem Glas enthaltenen Honigs essen, um fit genug für den letzten Teil dieser Challenge zu sein. :)
In deinem Stoffwechsel wird nun die im verzehrten Honig enthaltene Glucose mit Hilfe von Sauerstoff zu CO2 und H2O oxidiert (Prozess der aeroben Atmung).
Welche Energiemenge ΔHR wird bei diesem Abbauprozess der gegessenen Glucose freigesetzt?
Lasst uns weiterhin annehmen, unter den gegebenen Bedingungen (Druck, Temperatur) herrschten folgende molare Bildungsenthalpien:
ΔHf(H2O) = - 285,9 kJ/mol.
ΔHf(CO2) = - 393,5 kJ/mol.
ΔHf(C6H12O6) = - 1268 kJ/mol.
