如何同时表达多个基因呢?
多个质粒混合起来转染:随着混合质粒的种类增多,随机性就越大,不能保证每个细胞都获得了等量的每种质粒。
使用多个启动子,将各个“启动子-ORF”拼接策略,存在两个问题:一是启动子的个头不小(如常用的CMV启动子超过500 bp,EF1α启动子超过1.1 kb),多个启动子会导致载体显著增大,可能会给后续的实验带来麻烦;二是强启动子太多,容易给宿主细胞带来代谢负担,换用弱启动子,表达丰度不够。而如果想实现外源基因的串联表达——也就是说,前一个基因表达,势必引起后一个基因表达——那么多启动子的策略并不可行。
多顺反子元件近乎完美地解决了上述问题。单顺反子,意思就是这段DNA中,含有编码单一蛋白的基因。而多顺反子(Polycistron或Multicistron),顾名思义,就是这段DNA中含有编码多个蛋白的基因。多顺反子常常存在于原核生物中,一个转录本,可以翻译出多个蛋白。而真核生物,则多利用单顺反子策略。
在分子克隆中,我们可以利用原核生物的这一特点应用于真核生物之中,即使用多顺反子元件载体,将多个ORF串联起来,同时表达多个基因。其中,IRES元件和2A多肽元件是最常用也是最容易使用的。
IRES——Internal Ribosome Entry Site(内部核糖体进入位点)
mRNA的翻译,依赖于核糖体的结合,并识别起始密码子,沿着5’→3’端进行。但是,起始密码子序列(比如AUG)在一个转录本中是广泛存在的,那核糖体又是如何认得最最开始的那个AUG序列呢?其实道理很简单,在真核生物中,绝大多数转录本的翻译,同时还依赖于5’端的一个特殊结构,简称为“帽子”(cap)。只有识别到cap,核糖体才会结合到mRNA,扫描起始密码子,从而继续后续的翻译进程。
然而,真核生物还有一小部分基因的翻译,可以不依赖于cap。其中研究最为深入的,便是IRES依赖通路。IRES是一个相当古老的基因元件,最早在脊髓灰质炎病毒(Poliovirus)中发现,在部分真核生物的基因(如某些生长因子,甚至某些原癌基因)中也存在。IRES为核糖体在转录本的内部提供了一个新的“落脚点”。即使不存在cap, 核糖体也能与之结合,并扫描起始密码子。
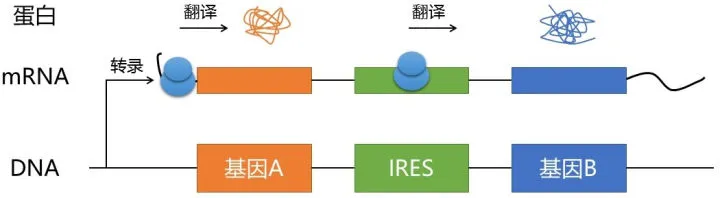
如今,IRES成为多个基因串联表达的实用工具。它最大的优点是,后一个基因的ORF并不需要和前一个基因的ORF同框,因为核糖体会重新扫描后一个基因的起始密码子,而不依赖于前面的ORF结构。这样一来,克隆工作就简单得多了。
但是,IRES也有很明显的缺陷。一是这个元件的块头也不小(500-600 bp),二是后一个基因的表达强度,往往低于前一个基因。
2A多肽元件(2A peptide)
和IRES元件一样,2A多肽元件也最早在病毒中发现(小RNA病毒,Picornavirus),且直到目前为止,仅在病毒中发现。而尽管真核生物基因组中并不存在2A,但2A介导的多顺反子表达却广泛存在。(注:目前为止,尚未发现原核生物中存在2A介导的多顺反子表达途径。)
2A元件是一类编码约仅有20个氨基酸多肽的序列(如下图所示),它能阻止翻译过程中氨基酸形成共价键,并维持翻译继续进行。这样一来,翻译产物就被“切了一刀”,变成两段(比较正式的叫法是“顺式水解反应”,或者说“自切割”)。2A元件的共有序列是D(V/I)ExNPGP。其中,x是任意氨基酸,而“下刀”切割的位点,就在最后两个氨基酸G和P之间。
除了上图明示的序列外,在2A元件的5’端加上编码GSG三肽的序列,可以显著提高切割效率
2A多肽元件用于多基因串联表达,具有IRES无可比拟的优势。第一,2A非常短,克隆甚至直接合成非常方便。第二,在理想情况下,2A介导的自切割效率几乎是100%。这也是目前为止唯一能够保证串联基因等量表达的策略。
但是,2A多肽元件也是有缺点的。首先,前一个蛋白的C端会多了一小段外源多肽,后一个蛋白的N端也会多一个脯氨酸(Proline)。虽然在绝大多数情况下,这不会影响蛋白质的功能。但有时候运气不好起来,什么事情都有可能发生,做实验的人都懂。其次,后一个ORF要和前一个ORF同框(貌似这不算是什么缺点),否则就姨妈(雾——移码了)。最后,不同的2A多肽,在不同物种甚至细胞种类之间的切割效率是不一样的(有的能接近100%,有的可能只有50%)。
此外值得注意的是,当要串联表达3个以上蛋白时(即使用2个以上2A多肽元件),请注意使用不同种类的2A来间隔ORF。否则重复出现相同的序列,在脸不好看的情况下,可能会导致一些奇怪的重组现象。