Los cicloalcanos pertenecen a la familia de compuestos orgánicos saturados que cumplen con la formula CnH2n, esta fórmula también corresponde a la de los alquenos pero la diferencia radica en que la insaturación no se debe a un doble enlace sino a una cadena cerrada o anillo.

Modelo de la molécula de ciclobutano. Fuente: wikipedia.com, imagen de dominio público.
A pesar de tener una estructra cerrada, sus propiedades químicas
y físicas son similares a los alcanos. Igual que estos solo poseen átomos de
carbonos e hidrógenos en su estructura, son moléculas neutras por lo que
interaccionan mediante fuerzas de tipo Van der Walls. Y así como el resto de los
hidrocarburos, sirven como combustibles, liberando calor cuando se queman en
atmosferas de oxígeno.
Los cicloalcanos de bajo peso molecular son gaseosos, y a
medida que se incrementa el número de átomos de carbono en la molécula también
lo hacen las fuerzas intermoleculares que actúan sobre ella, de modo que los de
mayor peso pueden ser líquidos, y estos tienen la propiedad de disolver moléculas
apolares, grasas o lubricantes. Pero las moléculas de mayor número de átomos de
carbono tienden a ser más inestables que su similar de cadena abierta, lo que
puede deberse a tensiones que se producen sobre la estructura por su misma
forma; si comparamos la molécula de ciclobutano con una de mayor tamaño
podremos observar que mientras menos átomos de carbono tiene la molécula esta
será más cerrada mientras que cuanto más átomos tenga se asemeja más a un
collar que a un anillo.

Cicloalcanos monocíclicos. Fuente: wikipedia.com, imagen de dominio público.
Propiedades generales
Los cicloalcanos, como los
alcanos, están sujetos a fuerzas intermoleculares de dispersión de London.
Estas interacciones intermoleculares débiles dan como resultado
puntos de fusión y ebullición relativamente bajos. Al
igual que los alcanos, los cicloalcanos no son particularmente reactivos, con
la excepción de los cicloalcanos más tensos y pequeños. Por otro
lado, al tratarse de anillos, estos compuestos poseen una mayor área de
contacto, lo que favorece a las fuerzas de interacción entre sus moléculas;
permitiendo así que se agrupen e interactúen de mejor forma en comparación con
los alcanos; y de aquí que sus puntos de ebullición y fusión sean superiores a
la de estos.
Insaturación
Los cicloalcanos también son considerados hidrocarburos insaturados, ya notamos que cumplen con la misma fórmula que los alquenos, ¿por qué?, porque no tienen la posibilidad de incorporar otro átomo de hidrogeno en la molécula, como sabemos para que un hidrocarburo se considere saturado debe tener el máximo número posible de enlaces C-H. Y para que un cicloalcano admita otro átomo de hidrogeno se debe abrir el anillo, lo que lo convierte en un alcano lineal
Estructura
Los cicloalcanos están
compuestos por átomos de carbono e hidrógeno hibridados sp3 conectados por
enlaces sigma. Sin embargo, a diferencia de los
hidrocarburos lineales, que pueden lograr una configuración tetraédrica más
estable alrededor de cada átomo de carbono en el esqueleto, los ángulos de
enlace en los cicloalcanos están restringidos, produciendo una tensión de anillo.
Para lograr una configuración más óptima, los anillos forman estructuras
arrugadas en lugar de planas. El ciclohexano forma una
configuración llamada configuración de silla, junto con una configuración de
bote menos estable.
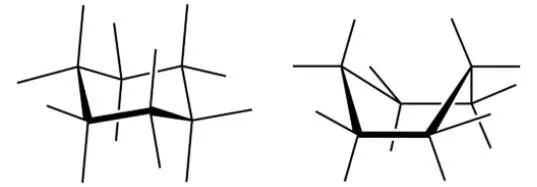
Configuraciones de silla y bote de ciclohexano. Fuente: chemlibretexts.com, contenido de dominio público.
Reacciones
Los cicloalcanos sufren
reacciones similares a los alcanos. Estos reaccionan con el oxígeno para formar
dióxido de carbono y agua, típica reacción de combustión. De igual
forma, los halógenos moleculares (Cl, F, Br) reaccionan con los cicloalcanos en
presencia de luz ultravioleta o calor para formar haluros de alquilo. La halogenación es una reacción de sustitución, en la que un hidrógeno
en los cicloalcanos se reemplaza por un halógeno.

Reacciones del ciclohexano. @emiliomoron.
Usos
El uso de los cicloalcanos depende del número de carbonos en
su estructura. Los más livianos y gaseosos, sirvieron para alimentar lámparas
de gas para el alumbrado. Por otro lado, los líquidos tienden a usarse como
solventes de grasas y aceites, de naturaleza polar. Muchos cicloalcanos se utilizan en combustible para
motores, gas natural, gas de petróleo, queroseno, diesel y muchos de los más
pesados se en emplean en aceites lubricantes.
Referencias
Wikipedia.com. Cicloalcano.
Chemlibretexts.com. Physical Properties of Cycloalkanes.
Enciclopedia Britanica. Cicloalcanos.
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2019/06/cicloalcanos-propiedades-y-reacciones
