¡Hola estimados amigos de Hive!
Un precipitado lo podemos definir como un sólido insoluble que se puede separar por filtración de la solución madre a partir de donde se formó al llevarse a cabo una reacción de precipitación.
La reacción se puede representar en forma general como:

Donde A corresponde a la especie a determinar (analito), R al agente precipitante y AaRr al precipitado.

Fuente:@yusvelasquez
Consideremos por ejemplo, el CaCO3 que corresponde a este tipo de compuesto poco soluble. Si se añade carbonato de calcio a 100 mL de agua y se agita con fuerza podremos observar que la mayor parte del compuesto permanecerá sin disolverse. Aunque se adicione más sal solo es posible que se disuelva al llegar al equilibrio y se tenga una solución saturada. Para este tipo de equilibrio se expresa la constante del producto de solubilidad que se expresa de la siguiente manera:
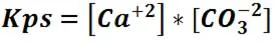
Cuyo valor teórico para el CaCO3 es 4,8*10-9 a 25°C.
Asimismo, podemos encontrar tabulados en la bibliografía los valores para distintos compuestos pocos solubles.
Ahora bien, una de las principales aplicaciones del producto de solubilidad es que a partir de las reacciones de precipitación y su constante se puede obtener información de las concentraciones de los iones que debe contener una solución para saber si se formará o no precipitado.
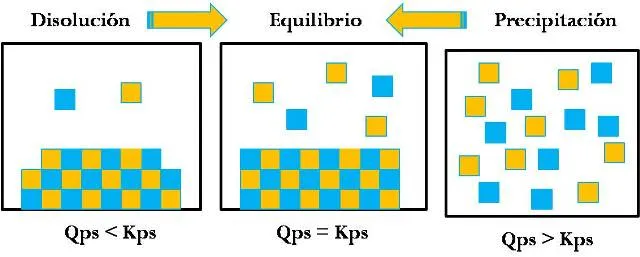
Cabe destacar que para que se forme un precipitado debe rebasarse el Kps del compuesto. En función a ello se tienen 3 casos posibles al comparar el Kps con el Qps calculado bajo determinadas condiciones. Por lo que se tiene:
Caso 1
Qps = Kps Se tiene una solución saturada, por lo que no se formará precipitado.
Caso 2
Qps < Kps La concentración de iones disueltos en la solución es menor a la requerida en el equilibrio, por lo que predominará la reacción directa y el proceso de disolución. No se formará precipitado.
Caso 3
Qps > Kps La concentración de iones disueltos en la solución es mayor a la requerida en el equilibrio, por lo que predominará la reacción inversa y el proceso de precipitación. Si se formará precipitado.
Fuente: @yusvelasquez
Por otra parte, al hacer reaccionar dos compuestos y originar los productos se puede cualtitativamente estimar cual tendrá tendencia a formar precipitado basándose en las reglas de solubilidad que se muestran a continuación:

Fuente: Datos tomados de Atkins, 2006
Pasos para la predicción de la formación de precipitados a partir del producto de solubilidad

Fuente:@yusvelasquez
Aplicación del producto de solubilidad para la predicción de la formación de precipitados
Predecir si se formará precipitado si se mezclan 200mL de cloruro de plata 1x10-4 M con 900mL de cloruro de potasio 1x10-6 M
Paso 1: Reacción química

Paso 2: Deducir el compuesto que puede formar precipitado.
Como podemos observar los productos de la reacción corresponden al cloruro de plata y nitrato de potasio. Si nos basamos en las reglas de solubilidad presentadas anteriormente, el nitrato de plata es un compuesto completamente soluble por lo que el que puede formar precipitado es el cloruro de plata.
El cloruro de plata se caracteriza por ser un precipitado coloidal de color blanco y cuyo Kps es 1,6x10-10
Paso 3: Reacción de disociación del compuesto poco soluble

Paso 4: Cálculo del Qps
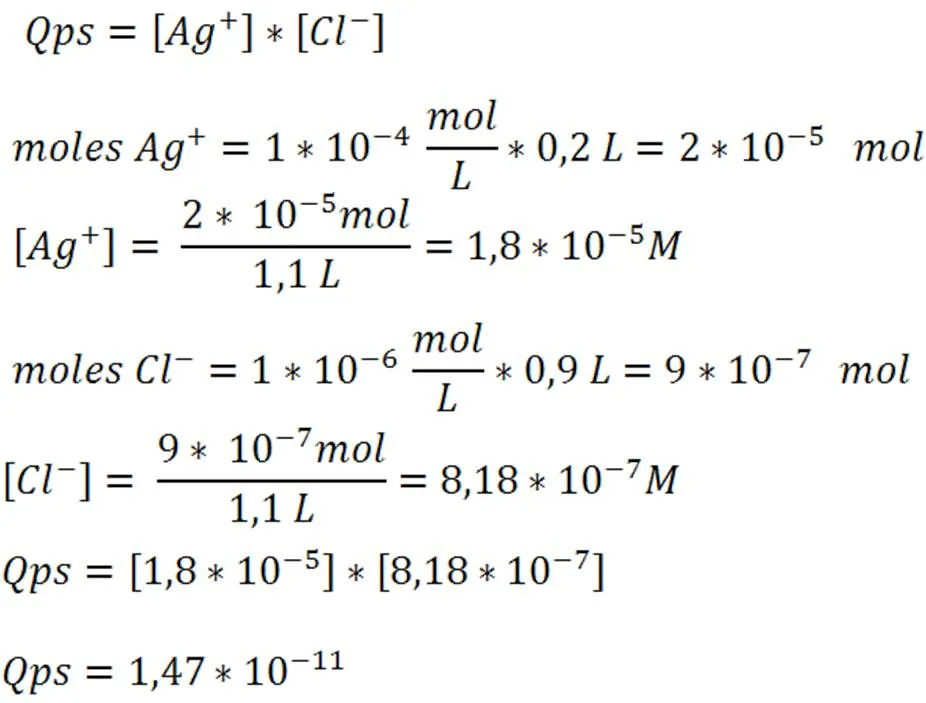
Paso 5: Comparación del Qps y Kps
Partiendo del dato de Kps del cloruro de plata extraído de la bibliografía se hace la siguiente comparación
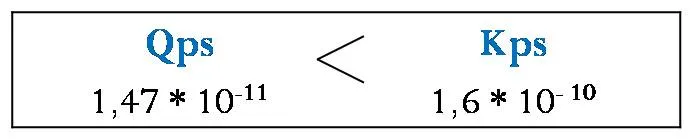
El valor de Qps calculado es menor que el Kps del compuesto, por lo tanto no se formará precipitado bajo las condiciones dadas.
Este tipo de cálculos es importante en química, en especial en el análisis gravimétrico, donde el analito que se desea determinar se precipita, se separa de la solución, se lava , se pesa y a partir de su masa se calcula su concentración. En él área ambiental es muy utilizado para la determinación de metales pesados en muestras de agua, por lo que debe calcularse las concentraciones que se debe adicionar del agente precipitante para lograr así la separación.
¡Hasta aquí el presente post, espero les sea útil la información, hasta una próxima oportunidad!
Referencias
- Whitten,K. (1985). Química General). Interamericana
- Atkins, J. (2006). Principios de Química. Panamericana
