
En esta ocasión les compartiré una introducción sobre la espectroscopia de fotoelectrones emitidos, conocida como XPS por sus siglas en inglés (XPS: X-ray Photoelectron Spectroscopy). Dicha técnica de caracterización de nanomateriales nos permite determinar la composición química en la superficie y el estado de oxidación de los elementos presentes en los materiales, entre otras propiedades.
La espectroscopia de electrones fotoemitidos se basa en el efecto fotoeléctrico [1]. Para explicar el fundamento físico del proceso de fotoemisión nos apoyaremos del esquema en la Figura 1. En donde observamos que al hacer incidir una energía hv (línea color naranja) sobre un átomo se origina una ionización. La energía de hv debe ser mayor a la energía de enlace del electrón para que este sea expulsad al vacío con una energía cinética. Cuando el fotoelectrón sale al vacío es direccionado por unas lentes electrostáticas a un analizador de electrones, para que el electrón llegue al analizador sin perder su energía el proceso debe ocurrir en una cámara de ultra alto vacío (≥10−10 Torr). Después de que es detectado lo que representamos en un espectro donde observamos picos en energía correspondientes a ese electrón (ver Figura 2).
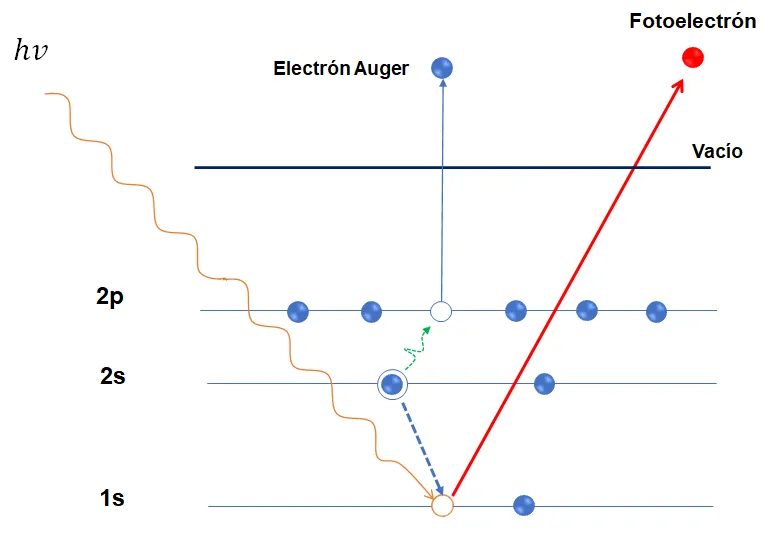
Cuando el átomo queda ionizado, hay probabilidad de que ocurra un segundo fenómeno (observe las líneas azules en la Figura 1). Debido a que el átomo tiende a recuperar su estado basal, un electrón de un nivel de energía superior (por ejemplo del orbital 2s) baja al sitio disponible en el orbital 1s, liberando energía. Esa energía puede ser utilizada por otro electrón del mismo nivel o de un nivel superior para salir al vacío, dicho electrón es conocido como electrón Auger [2]. Para efectos de la explicación de la figura, utilizamos la nomenclatura por orbitales s, p, d y f, pero en la espectroscopia Auger se utiliza la nomenclatura del tipo K, L, M y N para indicar los niveles.
En base que cada electrón posee una energía de enlace característica es posible identificar a que átomo pertenece y a que nivel. Por eso esta técnica es útil para conocer la composición química de la superficie de materiales sólidos. Es importante resaltar que como las mediciones se realizan en cámaras de alto vacío no es posible analizar muestras en estado gaseoso o líquido.
En la Figura 2, les muestro un espectro típico de un compuesto orgánico. En donde podemos identificar los picos de XPS característicos correspondientes al oxígeno (O 1s) y carbono (C 1s). Además, se observan las señales Auger de estos mismos compuestos. Nótese que en el eje X se indica la energía de enlace en unidades de electrón-volts (eV) y en el eje de las Y comúnmente se grafica la intensidad en unidades arbitrarias (u.a.). Sin embargo, esta intensidad se puede expresar en cuentas por segundo (cps), por lo que en algunos artículos científicos o libros podría encontrar al eje de las Y expresado de esta forma.

¿Por qué se considera a la espectroscopia XPS como una técnica de superficie?
Esta técnica permite conocer la composición química de la superficie (los primeros 10 nm). Esto se debe a que el electrón que se emite al vacío debe salir sin perder energía, esto quiere decir que debe evitar chocar con otros electrones en el interior del sólido. Entre más profundo este el electrón en el sólido mayor será la probabilidad de que choque con otros electrones. A un electrón en el sólido le puede ocurrir alguno de los siguientes cuatro fenómenos antes de salir al vacío [3].
El electrón no experimentó choques inelásticos (salió sin pérdida de energía).
El electrón chocó con otro electrón en el interior del sólido, pero perdió una parte de su energía.
El electrón chocó con otro electrón en el interior del sólido y perdió la mayor parte de su energía.
El electrón perdió toda su energía y nunca solio del sólido.
Un último concepto que quiero mencionar en esta introducción al tema es la importancia del camino libre medio inelástico (IMFP: Inelastic Mean Free Path, por sus siglas en ingles). Se refiere a la distancia promedio que puede recorrer un electrón en un sólido antes de chocar con otro electrón y tiene un valor diferente para cada material. Este valor es un parámetro importante a la hora de calcular la composición química de los elementos que están presentes en el material.
Tres puntos importantes sobre espectroscopia XPS:
- La espectroscopia de electrones fotoemitidos XPS es una técnica de superficie que se basa en el efecto fotoeléctrico.
- Mediante un análisis de XPS es posible determinar la composición química en la superficie de los materiales así como los estados de oxidación de los elementos presentes.
- En los espectros de XPS se grafica la energía de enlace en unidades de eV contra la intensidad (u.a.) o en cuentas por segundo (cps).
Referencias
- Johanna M.Wagner, editor. X-ray Photoelectron Spectroscopy. New York: Nova Science Publishers, Inc.; 2011. 290 p.
- Thomas A. Carlson. Photoelectron and Auger Spectroscopy. 2nd Ed. David Hercules, editor. New York and London: Plenum Press; 1978. 427 p.
- Van Der Heide P. X-ray Photoelectron Spectroscopy: An introduction to Principles and Practices. United States of America: John Wiley & Sons, inc., 2012. 262 p.

Fundador de la Comunidad Alebrijes y Co-fundador de Hive México
