Como les había comentado en mi anterior post, la oxidación del hierro es un tema importante, ya que es uno de los principales materiales de construcción, tanto de edificaciones como medios de transporte, entre otros. Así que siendo la oxidación del hierro un proceso completamente natural y prácticamente inevitable, es lógico que a la par del desarrollo tecnológico en torno al hierro se hayan desarrollado métodos para retrasar su corrosión; una de las formas más comunes para proteger los elementos de hierro son los métodos de barrera, lo que básicamente consiste en recubrir la pieza con una capa de alguna sustancia que limite su exposición al oxígeno atmosférico, como es el caso de las pinturas o el recubrimiento con otro metal (por ejemplo el galvanizado).
Sin embargo hay situaciones en las que el recubrimiento no es suficiente, y se hace uso de otro método, conocido como protección catódica. Gracias a los diferentes potenciales de reducción que tienen los metales, estos no se oxidan con la misma facilidad, haciendo unos más susceptibles que otros a sufrir la corrosión, valiéndonos de esta características podemos instalar elementos de un metal diferente al hierro de la estructura que deseamos proteger, para que sea este quién reaccione con el oxígeno del ambiente y sufra la corrosión, por eso se les conoce también como ánodos de sacrificio.
Demostración de la protección catódica con un ánodo de zinc. Fuente: @emiliomoron.
En este post quiero compartir un experimento muy sencillo de cómo funciona la protección catódica de un elemento de hierro, mediante la utilización de materiales que disponemos en casa, siendo un método didáctico para continuar demostrando los diferentes procesos ligados al tema de la corrosión, especialmente lo relacionado a las reacciones de óxido reducción.
Empecemos por definir bien algunos conceptos.
¿Qué es la protección catódica?
Este es un método utilizado para controlar la corrosión galvánica de un metal, haciendo que toda la superficie metálica se convierta en el cátodo una celda electroquímica cuando se sumerge en un electrolito[1]. Esto se logra haciendo que el potencial de reducción del metal a proteger se vuelva más electronegativo mediante la aplicación de corriente directa o mediante el contacto con metal menos noble, denominado ánodo de sacrificio.
El ánodo de sacrificio es una opción muy utilizada en estructuras expuestas al ambiente marino, básicamente consiste en la colocación de un metal más activo, es decir, con menor potencial, que el metal que forma la estructura, dando lugar a la protección catódica; ya que toda la estructura actuaría como cátodo y el metal más activo como ánodo. Por ejemplo, para proteger el casco de hierro de los barcos se utilizan ánodos de zinc, un ejemplo se observa en la siguiente imagen.

Ánodo de zinc instalado en un barco, nuevo y usado. Fuente: Wikipedia.com, imagen CC BY-SA 3.0
Como se puede observar, el que sufre la corrosión es el metal que constituye el ánodo, por lo que cada cierto tiempo habrá que sustituirlo.
Combinación de metales
Para que la protección catódica funcione, el metal que funcionará como ánodo de sacrificio debe tener un potencial menor (más negativo) que el potencial del metal que compone la estructura a proteger, y que funciona como ánodo, cuando se toma como referencia un electrodo de cobre/sulfato de cobre. En la siguiente imagen podemos observar el potencial de algunos metales.
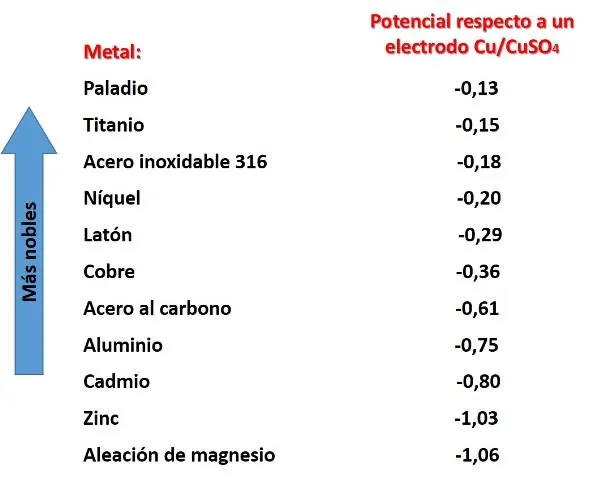
Potenciales de reducción de algunos metales. Fuente: Imagen del autor con datos tomados de Wikipedia.com.
De acuerdo a la imagen no cualquier metal puede brindar protección al acero, solo los que están por debajo de él en la lista, como el aluminio, el zinc o el magnesio.
Procedimiento y discusión
Para iniciar necesitamos los siguientes materiales:
- Un par de clavos normales de hierro
- Un trozo de alambre de cobre
- Un trozo de lámina de zinc
- Y un plato desechable de plástico
- Agua con un poco de sal disuelta

Metales a utilizar. Fuente: @emiliomoron.
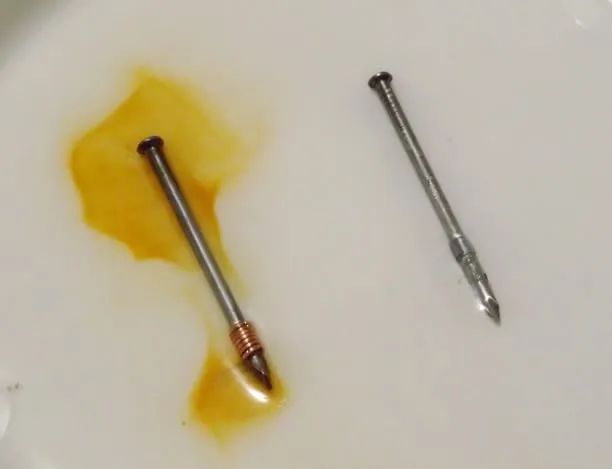
El procedimiento es muy sencillo, tomaremos uno de los clavos y en un extremo enrollaremos el trozo de alambre de cobre, de forma similar, tomaremos el otro y le enrollaremos el trozo de lámina de zinc.

Clavos con los metales de la prueba. Fuente:@emiliomoron.
Luego colocamos ambos clavos en el plato de plástico y agregaremos suficiente agua con sal disuelta como para cubrir la mitad de los clavos y dejar parte de su superficie expuesta. Siendo la corrosión un proceso electroquímico, solo provee un medio para acelerar el proceso.

Clavos colocados en la solución. Fuente: @emiliomoron.
Pasadas unas horas comenzaremos a observar que en torno al clavo que tiene el cobre enrollado se comienza a formar una disolución de color naranja, mientras que nada ocurre en las proximidades del clavo con el zinc. Lo que estamos observando es la formación de óxido férrico en la superficie del clavo con el cobre enlazado. En las siguientes imágenes podemos comparar como se va coloreando la disolución con el óxido férrico a medida que transcurre el tiempo del experimento.
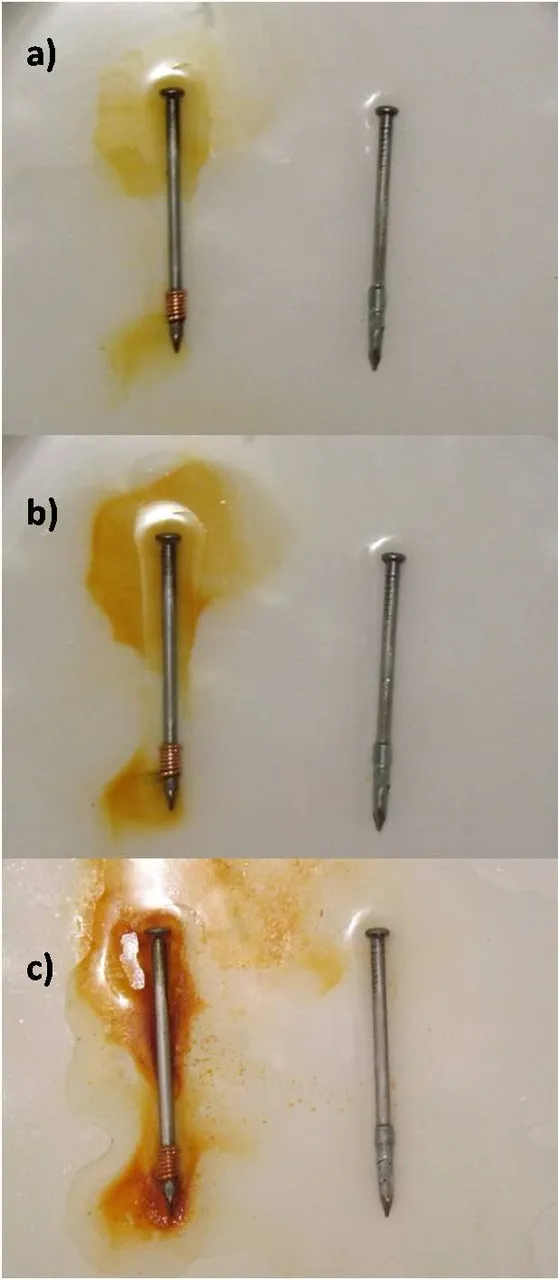
Avance de la oxidación en el experimento: a) 4 horas, b) 12 horas y c) 24 horas. Fuente: @emiliomoron.
Como podemos observar la disolución de color naranja solo se hace mayor en las proximidades del clavo con el cobre, sin embargo no notamos este efecto en torno al clavo con el zinc. En este caso estamos presenciando solo la oxidación del clavo con el cobre, por lo que el zinc ofrece protección al otro clavo. Como había explicado en mi anterior post, sobre el clavo de hierro se producen zonas anódicas y catódicas, en las zonas anódicas se produce la oxidación del hierro y en las catódicas la reducción del oxígeno, la reacción global se describe de la siguiente forma:
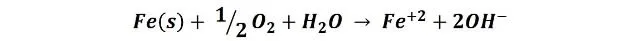
Luego los iones hierro reaccionan con el oxígeno disuelto del agua para producir óxido férrico, Fe2O3, el responsable de colorear la solución y la superficie de color naranja rojizo.
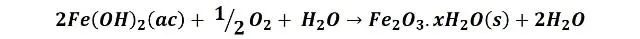
Estas reacciones también se producen sobre el clavo con el alambre de cobre, solo que, la zona catódica se sitúa preferentemente sobre el elemento de cobre, por lo que la reducción del oxígeno se producirá en este lugar; mientras que las zonas anódicas se localizaran a lo largo de todo el clavo, produciendo la oxidación del hierro. Si nos fijamos en la tabla de potenciales de reducción, el cobre es un metal menos activo que el hierro (más noble) por lo que el hierro tiene mayor facilidad para la corrosión que este, así que básicamente el elemento de cobre se resiste a la corrosión y la induce en el clavo.
Por otro lado, en el clavo que tiene el trozo de zinc enlazado no se observan señales de corrosión, en contraste a lo ocurrido con el otro clavo, el zinc es el elemento que sufre la corrosión al ser un metal menos noble que el hierro, debido a que su potencial de reducción es menor; así que en esta caso, es sobre el zinc donde se localizan las zonas anódicas, y es el que sufre la oxidación, mientras que el clavo actúa como cátodo, induciendo la reducción del oxígeno y salvándose así de la corrosión.
La oxidación del zinc que tiene lugar sobre el ánodo se describe según la reacción:
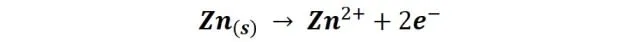
En cambio sobre el hierro se produce la siguiente reacción:
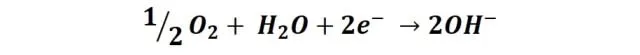
En la siguiente imagen podemos comparar el aspecto de ambos clavos luego de retirar de la solución y dejar secar:

Comparación de los clavos del experimento: con el zinc (izquierda) y con el cobre (derecha). Fuente: @emiliomoron.
Como se puede apreciar, la oxidación del clavo con el cable de cobre enlazado es muy evidente mientras que el otro clavo no sufrió el ataque de la corrosión en el tiempo del experimento.
Conclusión y aporte
Como hemos visto la protección del clavo gracias al zinc se produce porque el clavo se convierte en el cátodo de la celda electrolítica que ambos metales y el medio constituyen, por ello se conoce como protección catódica; siendo el zinc el que sufre la corrosión al constituir el ánodo, por ello se dice que es un ánodo de sacrificio. También hemos demostrado que no cualquier combinación de metales funcionará con el propósito de proteger el hierro, ya que, como hemos observado con el cobre enlazado al clavo, el efecto es contraproducente, más bien inducimos la corrosión del hierro.
Con el experimento se desarrolló una sencilla experiencia donde se ponen en evidencia estos conceptos, utilizando materiales disponibles en el hogar, por lo que puede ser utilizada como una referencia practica para actividades didácticas que permitan abordar y comprender el tema de la corrosión y la protección catódica.
Bueno amigos, hasta aquí el presente el post, espero que les haya gustado el experimento y les sea útil la información, muchas gracias por pasar a leer. Hasta el próximo!
Referencias
- Wikipedia.com. Protección catódica.
Las formulas, reacciones y estructuras químicas indicadas fueron elaboradas por el autor en Microsoft PowerPoint.
Y amigo lector, si desean consultar más artículos de interés científico y de excelente calidad, visiten la etiqueta #STEM-espanol, este es un proyecto adscrito a la comunidad académica y científica #STEMSocial en Hive, una comunidad que promueve contenido científico en las áreas de Ciencia, Tecnología, Ingeniería y Matemáticas.
